2019年11月5日,由全球領先的交易雜誌Generics Bulletin主辦、全球知名一體化信息和技術型醫療服務提供商IQVIA協辦的Global Generics & Biosimilars Awards 2019(2019全球仿製葯與生物類似葯獎)頒獎典禮在德國法蘭克福舉行。復宏漢霖(2696.HK)在此次頒獎典禮上大放異彩,斬獲 「Biosimilar Initiative of the Year」(年度突破性生物類似葯獎 – 汉利康®,HLX01利妥昔單抗注射液)併入圍 「Company of the Year, Asia-Pacific」(亞太地區年度企業獎),這也是中國企業首次榮膺此項國際大獎。
此次獎項評審委員會由近20名來自相關行業的資深專家組成,歷經長達近兩個月公正公平的評審環節,復宏漢霖從上百家報名企業中脫穎而出。此次獲獎,不僅是對復宏漢霖在生物科技領域傑出表現的肯定,更是對復宏漢霖在亞太地區乃至全球行業影響力的認可。

2019年,復宏漢霖在生物類似葯領域有了舉世矚目的突破性進展。2019年2月,汉利康®(利妥昔單抗)經國家葯監局新葯上市註冊批准成為中國首個生物類似葯,並獲批原研利妥昔單抗在中國的所有適應症。5月16日,汉利康®成功開出第一張處方,正式拉開中國本土研發生物類似葯造福患者的帷幕,填補了我國生物類似葯市場的空白,增強了高品質生物葯的可及性,上市首月即造福了逾1000名淋巴瘤患者。
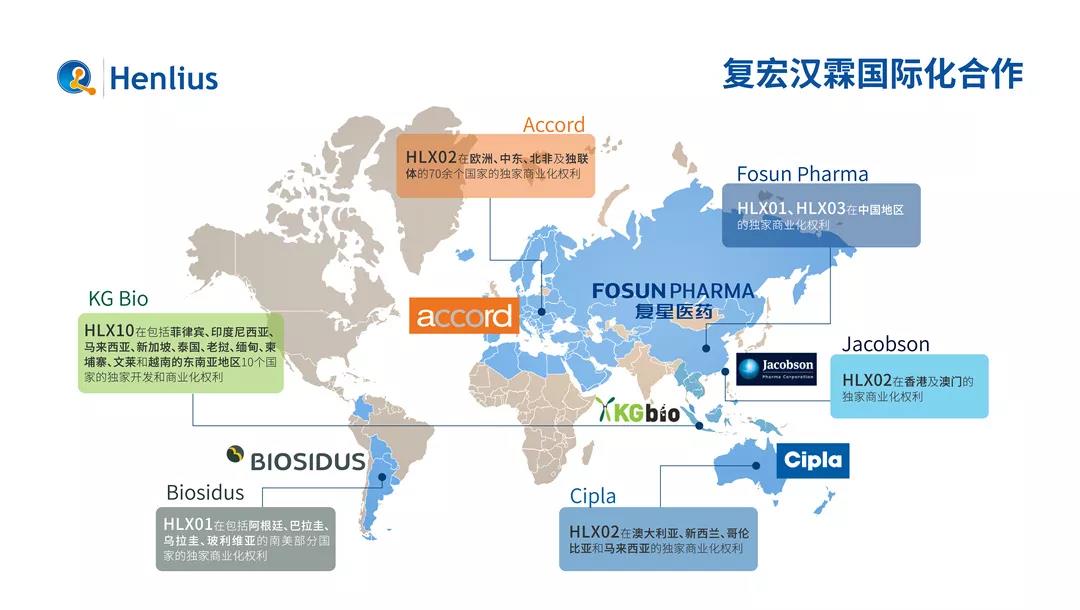
2019年,復宏漢霖也繼續在「紮根中國,布局全球」的發展道路上闊步前行。2019年6月,HLX02(注射用曲妥珠單抗)獲歐盟新葯上市申請受理,成為首個在歐盟報產的「中國籍」單抗生物類似葯。2019年,復宏漢霖在腫瘤免疫聯合療法領域提出了「聯合療法+全球化」的差異化戰略,以其自有抗PD-1/PD-L1單抗產品,積極聯合其他產品,同步在全球多個國家和地區開展臨床試驗。9月,復宏漢霖授予印度尼西亞製藥巨頭Kalbe Farma旗下控股子公司KG Bio就HLX10(抗PD-1單抗)在東南亞10個國家的獨家開發和商業化權利,將藉助Kalbe Farma在東南亞地區的大規模業務網絡,加快HLX10的國際化進程。近年來複宏漢霖攜手眾多國際知名生物技術和製藥企業,積極開展全球商業化布局,對外授權覆蓋全球92個國家和地區。
展望未來,復宏漢霖將充分發揮公司全球聯動、整合創新的優勢,繼續推動國際化戰略的落地,以對標國際質量標準,持續打造質高價優的生物葯產品,為實現成為全球最受信賴和景仰的創新生物醫藥公司的願景而不懈努力。
關於全球仿製葯與生物類似葯獎
全球仿製葯與生物類似葯獎旨在獎勵這兩個行業中的「最佳實踐」,以鼓勵促進業務發展的各方面改進措施。此獎項的核心是業務開發方面的突破——例如創新產品的開發,巧妙的許可交易或智能的法律操作,同時,認可行業內的最佳高管和領先公司也極為重要。每一項獎項都將有效地強調全球仿製葯和生物類似藥行業為各地更多病患提供更價優的藥品所做的努力。
關於復宏漢霖
復宏漢霖(2696.HK)是一家中國領先的生物製藥公司,旨在為全球患者提供質高價優的創新生物葯,產品覆蓋腫瘤、自身免疫性疾病等領域。自2010年成立以來,公司以全球聯動、整合創新為產品開發理念,在中國上海、中國台北和美國加州均設有研發中心,具備了協同增效的突出優勢。復宏漢霖主要的產品開發策略是仿創結合,從生物類似葯起步,逐步開發創新型單抗產品,結合自主開發的抗PD-1和PD-L1單抗,在國內率先推出免疫聯合療法,前瞻性布局了一個多元化、創新單抗及腫瘤免疫聯合療法管線,打造出研究、開發、商業化生產的綜合性生物醫藥全產業鏈平台。2019年9月25日,復宏漢霖在香港聯合交易所有限公司主板上市,股票代碼:2696。
截至目前,復宏漢霖已有1個產品成功上市,2個產品獲得中國新葯上市申請受理,1個產品獲得歐盟新葯上市申請受理,14個產品、6個聯合治療方案在全球範圍內開展20多項臨床試驗。其中,公司首款重磅產品汉利康®(利妥昔單抗注射液)於2019年2月獲國家葯監局新葯上市註冊批准,成為中國首個獲批上市的生物類似葯。HLX03(阿達木單抗注射液)與HLX02(注射用曲妥珠單抗)已獲國家葯監局新葯上市申請受理,現已納入優先審評程序。HLX02相繼在中國大陸、烏克蘭、歐盟波蘭和菲律賓全面啟動國際多中心3期臨床試驗,成為國內首個開展國際多中心3期臨床研究的生物類似葯,並於2019年6月獲歐洲藥品管理局上市申請受理。此外,公司已陸續就HLX10與自有產品HLX04(貝伐珠單抗生物類似葯)等單抗以及化療聯用開展多項腫瘤免疫聯合療法,在全球範圍內開展多個臨床研究。
